شیمی دهم؛ فلز، نافلز و شبه فلز چیست و چه ویژگیهایی دارد؟
امروز فضای مجازی و بستر اینترنت به یکی از مراجع مهم برای دانش آموزان تبدیل شده است تا با مراجعه به آن پاسخ بسیاری از پرسش های خود را بیابند.
تحریریه مدرسه آنلاین تلاش می کند تا در این بخش اطلاعات به روز و مستندی را پیرامون موضوعات درسی تهیه و در اختیار کاربران فضای مجازی قرار دهد.
امروز بحث فلز، نافلز و شبه فلز در شیمی دهم را با هم میخوانیم.
فلزات و نافلزات
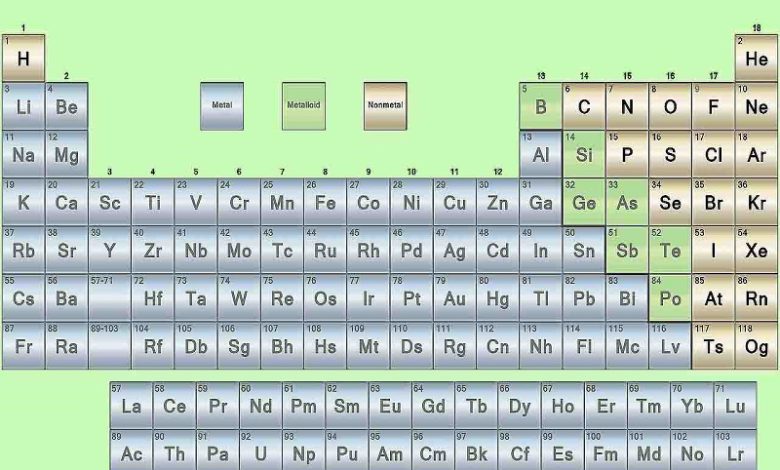
فلزات و نافزات مواد پیرامون ما را تشکیل میدهند. در حقیقت، عناصر را میتوان به فلز و نافلز تقسیم کرد و باید بدانیم که هریک در کدام دسته قرار دارند. فلزات – به طور مثال مس و آلومینیوم- رسانای خوب گرما و الکتریسیته هستند درحالیکه نافلزات – مانند فسفر و گوگرد – خاصیتی عایق دارند. بنابراین، فلز و نافلز را بسته به نوع خواص ماده میتوان از یکدیگر تشخیص داد.
فلز چیست؟
بیشتر عناصر جدول دورهای را تشکیل می دهد که دارای خواص زیر است:
-بیش از 80 درصد عنصرهای جدول را تشکیل میدهد. به طور عمده در سمت چپ و وسط جدول قرار دارد.
-خواص فیزیکی مانند رسانایی الکتریکی و گرمایی بالا، چگالی زیاد، درخشش فلزی، جلاپذیری، خاصیت مفتول و ورقه شدن، شکلپذیری و چکشخواری (پهن شدن در اثر ضربه) را دارد.
-در واکنش با دیگر اتم ها، الکترون از دست داده و کاتیون تشکیل میدهد.
-اغلب آنها واکنشپذیری بالایی دارند.
-مانندNa, Mg, Al, Sn, Pb
نکته: همۀ فلزات جدول جامد و تک اتمی است به جز جیوه (Hg) که تنها فلز مایع است.
از جمله عناصر فلزی میتوان به فلزات قلیایی، فلزات قلیایی خاکی، فلزات واسطه و همچنین لانتانیدها و اکتینیدها اشاره کرد. فلز و نافلز در جدول تناوبی به کمک یک خط زیگزاگ از یکدیگر جدا شدهاند. این خط از کربن شروع میشود و تا «رادون» (Radon) ادامه دارد. عناصر بین این دو، فسفر، سلنیوم و ید هستند.
ویژگیهای نافلزات چیست؟
-نافلزها به طور عمده در سمت راست و بالای جدول دورهای قرار دارند.
-سطح آن ها در حالت جامد درخشان نبوده و کدر هستند.
-جریان برق و گرما را عبور نمی دهند، به جز گرافیت که رسانای الکتریسیته است.
-در دمای اتاق و فشار 1 اتمسفر یا جامد یا گازی شکل هستند. (به جز برم که مایع است.)
-در حالت جامد در اثر ضربه خرد می شوند. (شکننده)
-در واکنش با دیگر اتمها الکترون به اشتراک میگذارند یا میگیرند.
-مانند کربن C6, فسفر P15, گوگرد S16, کلر Cl17.
نافلزها مانند فلزات، براق و چکشخوار نیستند و نمیتوان از آنها برای هدایت جریان الکتریکی استفاده کرد. همین خواص هست که سبب میشود تا به راحتی، تفاوت فلز و نافلز را درک کنیم.
اشتراک میان خواص نافلزات از فلزها بسیار کمتر است زیرا خواص فیزیکی و شیمیایی آنها تغییرات بسیار زیادی دارد. برخی نافلزات، جامد و برخی در دمای اتاق، به حالت گاز قرار دارد. عناصر نافلزی شامل گوگرد، کربن، هالوژنها، فسفر، هیدورژن، اکسیژن، سلنیوم، نیتروژن و گازهای نجیب است. در جدول تناوبی، نافلزات در سمت چپ هالوژنها و سمت راستِ شبهفلزات قرار دارد.

شبه فلزات و خواص آنها
عناصری هستند که همانند مرزی بین فلز ها و نافلزها قرار دارند. برخی از خواص فیزیکی آنها شبیه فلزها اما خواص شیمیایی آنها شبیه نافلزهاست.
اگر یک عنصر را نتوان جزو فلز و نافلز طبقهبندی کرد، آن را جزو شبه فلزها قرار میدهند. یعنی برخی خواص فلزات و نافلزات را دارد. مانند سیلیسیم که درخشان و شکننده بوده از طرفی نیمهرساناست.
-خواص فیزیکی آن ها بیش تر به فلزها شبیه است در حالی که رفتار شیمیایی آنها همانند نافلزهاست.
-اغلب رسانایی الکتریکی کمی دارد.(نیمه رسانا)
-در واکنش با دیگر اتم ها الکترون به اشتراک میگذارد.
-معمولا شکننده هستند و بر اثر ضربه خرد می شوند. Si14,32Ge.








