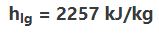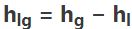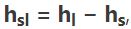شیمی یازدهم؛ همهی چیزهایی که باید دربارهی آنتالپی بدانید
امروز فضای مجازی و بستر اینترنت به یکی از مراجع مهم برای دانش آموزان تبدیل شده است تا با مراجعه به آن پاسخ بسیاری از پرسش های خود را بیابند.
تحریریۀ مدرسه آنلاین تلاش میکند تا در این بخش اطلاعات به روز و مستندی را پیرامون موضوعات درسی تهیه و در اختیار کاربران فضای مجازی قرار دهد.
امروز بحث آنتالپی در شیمی را با هم میخوانیم.
مفهوم آنتالپی
انرژی کل یک سامانه هم ارز با محتوی انرژی یا آنتالپی آن است. بنابراین هر سامانه در دما و فشار ثابت آنتالپی معینی دارد.
در واکنش های گرماگیر مواد با آنتالپی کم تر به مواد با آنتالپی بیش تر تبدیل میشوند.
در واکنش های گرماده مواد با آنتالپی بیش تر به مواد با آنتالپی کم تر تبدیل می شوند.
انجام واکنش همراه با داد و ستد انرژی در واکنش ها همراه است که این انرژی به شکل گرما ظاهر می شود. تغییر آنتالپی هر واکنش هم ارز با گرمایی است که در فشار ثابت با محیط مبادله می شود و با QP نمایش داده می شود.
نکته: واکنش های رفت و برگشت قرینه یکدیگر هستند.
آنتالپی استاندارد سوختن
آنتالپی استاندارد سوختن یک ماده، به تغییر آنتالپی فرایندی گفته می شود که طی آن، یک مول از ماده ای در مقدار کافی اکسیژن خالص بسوزد.
متان یک هیدروکربن است. هیدروکربن ها در واقع نوعی سوخت هستند و هرچه مقدار آن ها بر حسب گرم بیش تر باشد مانند این است که مقدار بیش تری سوخت را سوزانده باشیم پس گرمای حاصل نیز بیشتر خواهد بود. بنابراین در مقایسه آنتالپی سوختن هیدروکربن ها در درجه اول به مقدار آن ها بر حسب گرم توجه می کنیم. برای مثال گرمای حاصل از سوختن دو مول متان از گرمای حاصل از سوختن یک مول متان بیشتر است زیرا دو مول متان جرم بیشتری دارد و حاوی سوخت بیشتری است. همچنین آنتالپی استاندارد سوختن بوتان از آنتالپی استاندارد سوختن پروپان منفی تر است. زیرا جرم مولی بوتان بیشتر است و سوخت بیشتری دارد در نتیجه گرمای حاصل از سوختن آن نیز بیشتر است.
جرم مولی اتان بیشتر از اتن و اتن بیشتر از اتین است در نتیجه آنتالپی استاندارد سوختن اتان نیز از اتن بیشتر بوده و آنتالپی استاندارد سوختن اتن از اتین بیشتر است. اما آزمایش نشان داده است که اگر یک دماسنج را در فاصله معینی از شعله این سه هیدروکربن قرار دهیم، شعله اتین از همه داغ تر است و ترتیب دمای شعله به صورت مقابل خواهد بود:
اتان < اتن (اتیلن) < اتین (استیلن)
در حقیقت گرمای حاصل از سوختن با دمای شعله سوختن کاملا متفاوت است. در مقایسه دمای شعله سوختن باید به تعداد مول های گازی حاصل توجه کنیم.
همان طور که مشاهده می شود در سوختن یک مول اتان، 5 مول گاز تولید شده است پس گرمای حاصل از سوختن آن بین 5 مول گاز تقسیم می شود. در سوختن یک مول اتن، 4 مول گاز تولید شده است پس گرمای حاصل از سوختن بین 4 مول گاز تقسیم می شود. هم چنین در سوختن یک اتین 3 مول گاز تولید می شود در نتیجه گرمای حاصل از سوختن آن بین 3 مول گاز تقسیم می شود.
از آنجاکه گرمای حاصل از سوختن اتین بین تعداد مول های گازی کمتری تقسیم می شود و میانگین انرژی گرمایی گازهای حاصل از سوختن اتین بیشتر است، دمای شعله آن نیز بالاتر خواهد بود.
* شعلۀ اتین (استیلن) به قدری داغ است که از آن در جوشکاری استفاده می شود.
معادله واکنش سوختن گرافیت با معادله واکنش تشکیل (CO2(g از عناصر سازنده اش یکسان است بنابراین می توان گفت آنتالپی استاندارد سوختن گرافیت برابر آنتالپی استاندارد تشکیل (CO2(g است. در واقع در برخی از واکنش ها ممکن است ∆H چندین اسم داشته باشد. در این واکنش، ∆H ،هم آنتالپی استاندارد سوختن گرافیت و هم آنتالپی استاندارد تشکیل (CO2(g نام دارد.
آنتالپی در واکنشهای شیمیایی
از مفاهیم آنتالپی به شکل گستردهای در شیمی نیز مورد استفاده قرار میگیرد. معمولا فرآیندهای شیمیایی را از دیدگاه قانون اول و دوم ترمودینامیک بیان میکنند. در ترمودینامیک به مجموع انرژیهای سیستم به جز پتانسیل و جنبشی، «انرژی درونی» (Internal Energy) گفته میشود. همچنین آنتالپی یک واکنش شیمیایی برابر با تغییر آنتالپی هریک از اجزای تشکیل دهنده فرآیند است.
از آنجایی که اکثر واکنشهای شیمیایی به صورت فشار ثابت رخ میدهند، بنابراین میتوان مفهوم تغییر آنتالپی را در یک واکنش نیز تعریف کرد. معمولا این تغییر را تحت عنوان «آنتالپی واکنش» (Reaction Enthalpy) میشناسند. آنتالپی یک واکنش، بسته به نوع آن میتواند مثبت، منفی و یا صفر باشد. مثبت یا منفی بودن آنتالپی واکنش به گرماده یا گرماگیر بودن آن وابسته است.
آنتالپی تبخیر
در حالت کلی زمانی که در فرآیندی، یک ماده دچار تغییر فاز میشود، بخشی از انرژی سیستم صرف تغییر فاز مذکور میشود. برای نمونه ظرفی را حاوی مقداری آب تصور کنید که در حال حرارت دادن به آن هستیم. بدیهی است که در این فرآیند دمای آب درون ظرف افزایش مییابد. پس از گذشت زمانی، آب موجود در ظرف شروع به بخار شدن میکند. با اندازهگیری متوجه میشویم که دمای آب در این حالت ثابت است.
بنابراین با ثابت بودن دما، این سوال مطرح میشود که انرژی حرارتی اضافه شده به سیستم صرف چه چیزی میشود؟ پاسخ این است که حرارت اضافه شده به آن، صرف تغییر فاز آب میشود. در این حالت انرژی اضافه شده به سیستم را «آنتالپی تبخیر» مینامند. به اینگونه انرژیها «نهان» نیز گفته میشود.
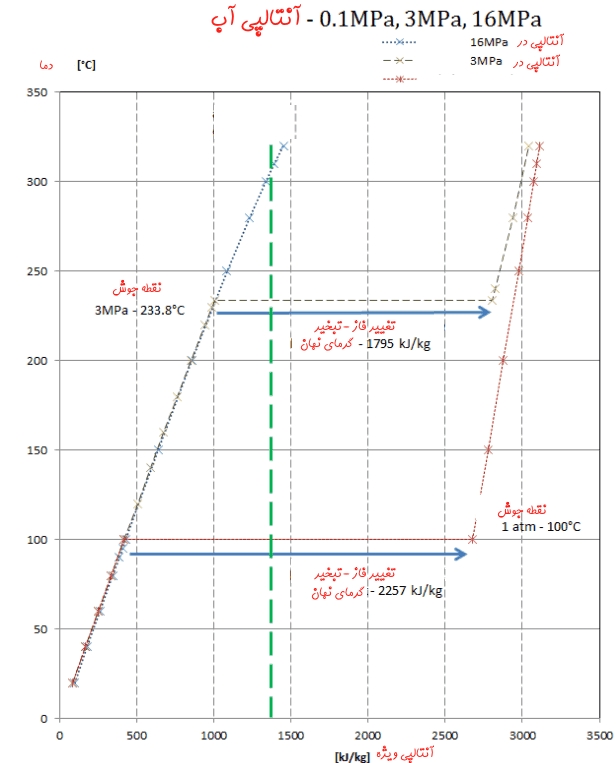
برای نمونه گرمای نهانِ تبخیر آب در فشار ۰.۱ مگاپاسکال برابر با مقدار زیر است:
همین مقدار در فشار ۳ مگاپاسکال برابر است با:
گرمای تبخیر عبارت است از میزان گرمایی که به منظور تبخیر شدن کاملِ مایع نیاز است. این مقدار را میتوان با استفاده از فرمول زیر توصیف کرد.
جالب است که با افزایش فشار سیال، مقدار گرمای نهان تبخیر آن کم میشود. نمودار زیر آنتالپی آب در دماها و فشارهای مختلف را نشان میدهد.
برای دیگر تغییر فازها نیز میتوان از این مفهوم استفاده کرد. برای نمونه به میزان انرژی مورد نیاز جهت ذوب کردن یک جرم، گرمای نهان ذوب ماده مذکور گفته میشود که میتوان آن را با استفاده از فرمول زیر توصیف کرد.
نکته: آنتالپی واکنش تشکیل پیوند قرینه آنتالپی پیوند است.
نکته: آنتالپی پیوند های متفاوت به دو عامل وابسته است:
1) مرتبه پیوند (تعداد پیوند های بین دو اتم): هر چه مرتبه پیوند بیش تر باشد، انرژی پیوند بیش تر است.
2) شعاع اتم های تشکیل دهنده پیوند: هرچه شعاع اتم های تشکیل دهنده پیوند بیش تر باشد، آنتالپی پیوند کوچک تر است. نکته: هم چنین در یک پیوند هرچه اختلاف الکترونگاتیوی بین دو اتم بیش تر باشد قطبیت پیوند بیش تر شده و جاذبه بین دو اتم قوی تر می شود لذا انرژی پیوند افزایش می یابد.
نکته: در اندازه گیری آنتالپی پیوند، همه مواد (واکنش دهنده ها و فراورده ها) باید گازی شکل باشند زیرا اگر ماده اولیه در حالت جامد یا مایع باشد باید مقداری انرژی صرف غلبه بر نیروهای بین ذره ای آن کرد. به عبارت دیگر مقداری انرژی صرف تبخیر یا ذوب آن ماده می شود که این امر اندازه گیری آنتالپی پیوند را دچار خطا می کند.
آنتالپی پیوند، راهی برای تعیین ΔH واکنش
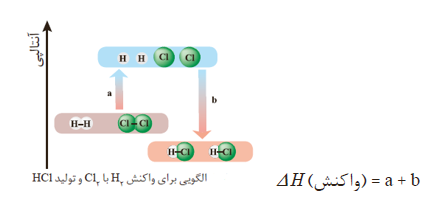
شیمیدانها به کار بردن آنتالپی پیوند و میانگین آن را روشی برای تعیین آنتالپی یک واکنش میدانند و این روش را برای واکنشهایی مناسب میدانند که همه مواد شرکت کننده در آن حالت گازی دارند و در واکنشهای گازی با مولکولهای پیچیده اغلب در مقایسه با دادههای تجربی، تفاوتی آشکار وجود دارد.
در یک واکنش شیمیایی تصور میشود که تعدادی از پیوندهای اشتراکی در مولکولهای مواد واکنشدهنده میشکند و تعدادی پیوند جدید تشکیل میشود تا مواد فراورده پدید آیند. در اثر شکسته شدن پیوند میان مواد واکنشدهنده انرژی مصرف شده و در اثر تشکیل پیوندهای جدید انرژی آزاد میشود. جمع جبری این انرژی ها معادل آنتالپی واکنش میباشد.