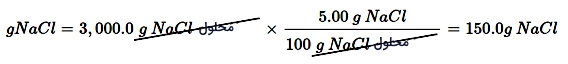غلظت محلولها در شیمی را به زبان ساده یاد بگیر

امروز فضای مجازی و بستر اینترنت به یکی از مراجع مهم برای دانش آموزان تبدیل شده است تا با مراجعه به آن پاسخ بسیاری از پرسش های خود را بیابند.
تحریریۀ مدرسه آنلاین تلاش میکند تا در این بخش اطلاعات به روز و مستندی را پیرامون موضوعات درسی تهیه و در اختیار کاربران فضای مجازی قرار دهد.
امروز در مورد غلظت محلولها و واحدهای آنها صحبت میکنیم. برای تعریف دقیق یک محلول، بهتر است غلظت آن را بیان کنیم. به عبارت دیگر باید ذکر کنیم که چه میزان حلشونده در مقدار مشخصی حلال، حل شده است. عباراتی مانند «رقیق» یا «غلیظ» به منظور توصیف مقدار ماده حل شده در محلولها بکار میروند. اما این عبارات، نسبی هستند و معنای دقیقی به دست نمیدهند.
غلظت
غلظت، معیاری برای سنجش میزان اختلاط یک ماده، در مادهای دیگر است. محلولها میتوانند رقیق یا غلیظ باشند. به طور مثال وقتی میگوییم سرکه، محلول ۵ درصد استیک اسید در آب است، در حقیقت غلظت آن را ذکر کردهایم. اگر این میزان به ۱۰ درصد افزایش پیدا کند، محلول مورد نظر غلیظتر از سرکه است.
یک محلول غلیظ، محلولی است که مقادیر زیادی از حل شونده در مقدار مشخصی از حلال در آن حضور دارند. در مقابل، محلول رقیق، محلولی است که مقادیر حلشونده در آن برای مقدار مشخصی از حلال، کم باشد.
همانطور که اشاره شد، عبارات غلیظ و رقیق برای توصیف کیفی محلولها مورد استفاده قرار میگیرند اما نیاز داریم تا روشهایی برای توصیف کمی محلولها پیدا کنیم.
درصد جرمی
روشهای مختلفی برای توصیف غلظت یک محلول از طریق درصد وجود دارد. درصد جرمی (جرم/جرم) به صورت جرم حلشونده به جرم محلول توصیف میشود:
100 × جرم محلول \ جرم حلشونده = درصد جرمی
جرم حلشونده + جرم حلال = جرم محلول
اگر بتوانید جرمهای حلشونده و حلال را اندازهگیری کنید، تعیین درصد جرمی ساده است. فراموش نکنید که هر کدام از اجزا باید با یک واحد تعریف شوند تا غلظت مورد نظر عدد درستی باشد.
مثال
فرض کنید محلولی با حل کردن 25 گرم شکر در 100 گرم آب تهیه کردهایم. جرم محلول عبارتست از:
125 گرم = ۱۰۰ گرم آب + ۲۵ گرم شکر
درصد جرمی محلول نیز به صورت زیر محاسبه میشود:
محلول شکر ۲۰٪ = 100 × (125 گرم محلول / ۲۵ گرم شکر) = درصد جرمی
استفاده از درصد جرمی در محاسبات
در مواقعی ممکن است بخواهید محلولی با درصد جرمی مشخص بسازید و نیاز به محاسبه میزان مورد نیاز جرم ماده حل شونده داشته باشید. درصد جرمی را میتوان به عنوان ضریب تبدیل با شکل زیر در نظر گرفت:
گرم حلشونده / 100 گرم محلول یا 100 گرم محلول / گرم حلشونده
به طور مثال، اگر نیازمند تهیه 3000 گرم از یک محلول ٪۵ سدیم کلرید باشید، نیاز به تعیین جرم حلشونده دارید:
معلوم: 3000 گرم محلولNaClNaCl ٪۵
مجهول: جرم حل شونده = ؟ گرمNaClNaCl
ضریب تبدیل = 100 گرم محلولNaClNaCl/ 5گرمNaClNaCl
برای حل این مثال کافی است تا جرم محلول در ضریب تبدیل ضرب شود:
مولاریته
«مولاریته»، معمولترین واحد غلظت در محلولها و همچنین به دلیل اینکه این واحد، استوکیومتری واکنشها را نیز شامل میشود، استفاده از آن بسیار پرکاربرد است. مولاریته(M) به صورت تعداد مول حل شونده در ۱ لیتر محلول تعریف و به طور مشابه، این واحد به صورت میلیمول حلشونده به ۱ میلیلیتر محلول نیز تعریف میشود.
در نتیجه واحد مولاریته، مول بر لیتر(mol/L) است که به اختصار با حرف M نمایش داده میشود. به طور مثال، ۱ مول ساکاروز (342 گرم) در میزان کافی از آب که در نهایت حجم یک لیتر از محلول را بدست دهد دارای غلظت1mol/L یا 1 مولار است. در شیمی، برای نمایش غلظت محلولها از کروشه استفاده میکنند. به طوریکه فرمول مولکولی یا نام ماده در داخل کروشه قرار بگیرد. مانند مثال زیر:
1M = [ساکاروز]
خوانش مثال بالا به این صورت است: غلظت ساکاروز، ۱ مولار است.
رابطه بین حجم، مولاریته و مول به شکل زیر قابل تعریف است:
VLMmol/L=L(Lmol)=moles
غلظتها در آزمایشگاه معمولا بر اساس نسبتهای جرم به جرم(m/m) یا جرم به حجم بیان میشوند.
منبع: فرادرس